| Lingua : |
|
| Comunità Encyclopedia |Enciclopedia Risposte |Invia domanda |Conoscenza Vocabolario |Carica conoscenza |
Dominio |
      |
|
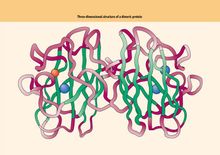
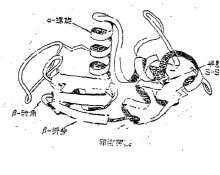
Dominio è macromolecole biologiche aventi una struttura specifica e regioni funzionali indipendenti, in particolare nella zona significa che la proteina. In proteine globulari, il dominio strutturale ha una sua specifica struttura quaternaria, la sua funzione dipende dalla porzione proteica del resto della molecola, ma con differenti domini di una proteina in una struttura secondaria non regolare da una breve sequenza collegata. I diversi domini proteici spesso causati da geni differenti esoni codificanti.Struttura All'interno della struttura delle tre unità di piegatura indipendente proteina. Più domini sono solitamente una combinazione di elementi strutturali super-secondaria si riferisce alla catena polipeptidica proteica basata sulla struttura in due ulteriori arricciata piegato in vari relativamente indipendente dell'assieme approssimativamente sferica. Dominio (Dominio strutturale) è tra la struttura secondaria e terziaria di un'altra struttura tra gli strati. Il cosiddetto dominio è chiaramente separato subunità proteiche nella zona vicina struttura sferica, zona conosciuta anche. La prima catena polipeptidica in certi aminoacidi residui adiacenti alla zona una struttura secondaria regolare è formata, e poi la struttura secondaria, ma anche dai pezzi assemblati vicine insieme per formare un super-strutture secondarie, sulla base delle pieghe catena polipeptidica una struttura terziaria simile a sferica. Per le molecole proteiche più grandi o subunità, spesso di un polipeptide a catena di due o più spazialmente distinguibili, relativamente indipendente dalle strutture regionali struttura terziaria associativa, queste strutture regionali relativamente indipendenti chiamato domini strutturali. Per le molecole più piccole o subunità proteiche, il dominio e la sua struttura terziaria è spesso un significato che queste proteine sono singoli domini o subunità. Dominio stesso è montata strettamente, ma la struttura del rapporto tra il dominio e il dominio permissive. Dominio e il dominio spesso hanno una lunghezza compresa tra catene peptidiche collegati a formare una cosiddetta zona cerniera. Diverse molecole proteiche in un diverso numero di domini, la stessa molecola proteica in diversi dominii simili o molto diversi tra loro. Dominio comune dei residui amminoacidici da 100 a 400, tra il dominio minimo solo 40 fino a 50 residui di amminoacidi, un dominio di grandi dimensioni può essere più di 400 residui amminoacidici. Natura Conosciuto anche come primitive. A piegatori di molecole proteiche, la molecola più grande proteina o pieghevoli tridimensionale di un livello subunità o un'entità tridimensionale relativamente indipendente. Una lunga pesca piegato catena polipeptidica è la fase finale di associare dominio (associazione), dal punto di molecole proteiche attivi o subunità. A livello (dimensionale) struttura della sequenza amminoacidica di certe regioni dei residui di amminoacidi adiacenti formano un (dimensionale) struttura secondaria regolare (come α-elica, β-volte, β-turn e random coil, ecc) , e poi la struttura secondaria dei pezzi adiacenti assemblati insieme per formare un super-strutture secondarie; Su questa base, ulteriormente piegata catena polipeptidica, o quasi sferica tridimensionali (livello) dalla struttura (a) dominio . Per una grande proteina globulare, spesso è una grande catena polipeptidica di due o più struttura tridimensionale solido tridimensionale relativamente indipendente fatta di associazione. Il dominio strutturale più comune contiene circa 100 a 200 residui di aminoacidi, generalmente almeno 40, più che può essere fino a 400, per le molecole più piccole o subunità proteiche, "domini" e "struttura terziaria" è spesso un concetto, cioè, queste proteine sono parte di un unico molecole di dominio (ad esempio uova lisozima). Dal punto di vista funzionale, molti del enzima è una proteina multi-dominio, il centro attivo si trovano tra domini, che si basa su: (1) per mezzo di uno specifico dominio facile da costruire disposizione tridimensionale del centro attivo, (2) dominio spesso solo brevi catene peptidiche collegati fra così incline al moto relativo tra domini, che sarà favorevole per il sito di legame substrati attivi o sollecitazione applicata, centri di aiuto combinano modulatori allosterici e si verificano effetti allosterici, per facilitare la reazione dell'enzima catalisi. Classificazione Al fine di studiare la struttura delle proteine, della Legge fondamentale, le persone utilizzano metodi diversi da angolazioni diverse per la classificazione della struttura della proteina conosciuta, alcuni sono basati sulla funzione biologica, alcuni sono basati sulla struttura stessa, una combinazione dei due insieme per la classificazione . Ad esempio, metalloproteinasi zinco è un tipo di catena peptidica catalitica, legame peptidico enzimi endopeptidasi idrolisi interni, anche se i singoli membri di una sotto-famiglia struttura complessiva spaziale significativamente diversi, ma le attività catalitiche della struttura è molto simile, quindi sono investiti in una classe di proteine. Tuttavia, la maggior parte delle persone hanno familiarità con, o M. Levitt e C. Chothia classificazione della struttura delle proteine. Questo metodo è una combinazione di struttura secondaria che la maggior parte della struttura del dominio di nucleo e la struttura della proteina che è diviso in quattro categorie: α-tipo, di tipo β, α / β-tipo e altri tipi di struttura di dominio. α-tipo struttura dominio è costituito principalmente dal α-elica, per esempio, la struttura della mioglobina. β-tipo di struttura di dominio è dominato da Bu anti-parallelo posato ripiegato, che di solito è due pacchi Bu ripiegato insieme con l'altro, come i plastidi struttura pigmento blu. α / β-tipo struttura dominio è avvolto dalla α-elica della β-catena di un parallelo orientato; modello β-α-β composto, per esempio, trioso fosfato isomerasi, glucosio isomerasi dominio catalitico la struttura. Alcune proteine sono discontinui α-e β-combinazione di pattern, e di solito è avvolto dalla parte α-elica di formazione della struttura del dominio di una piccola indietro β-ripiegato anti-parallelo, che possono essere considerati come appartenenti alla quarta categoria come struttura di nucleasi. Ci sono anche alcune piccole proteine, sono ricchi di legame disolfuro o di uno ione metallico, per formare un particolare tipo di struttura di queste proteine appare in larga misura da uno ione metallico o di ponti disolfuro, così sembra che convenzionale proteine sembrano disordinato. α-elica; α / β-tipo; Pieno β-pieghevole; Casuale tipo rotolo; Sostanza Dominio è essenzialmente una combinazione di struttura secondaria, struttura terziaria come utente. Ogni dominio rappresenta una funzione, rispettivamente. Esempi Ci sono 2 lattato deidrogenasi Phytophthora sfera di dominio proteico Archivio (Ig) dominio di 12 [VL (luce regione variabile della catena), CL (la catena leggera regione costante), VH (pesante regione variabile della catena), CH1 (pesante catena costante regione 1 ), CH2 (catena pesante costante regione 2), CH3 (catena pesante costante regione 3) ogni 2]. Ig regione variabile che determina la specificità di Ig e altre proprietà biologiche quali immunogenicità e attraversare la placenta, con il complemento (o macrofagi adsorbimento) e così determinato dalla regione costante. Forma: struttura di dominio tra lassista, crepe o fessure che formano spesso grotta ci sono molti non-polari residui di aminoacidi, che sono idrofobi, consentono molecole d'acqua di entrare, ma per accogliere sodio proteina cofattore o enzima substrato e di altre molecole. Significato: il sito attivo della struttura di proteine o di siti allosterici si trovavano nelle fessure. In quanto la connessione tra i domini flessibilità, ogni dominio può essere relativamente grande movimento relativo, le fenditure aperte o chiuse, per facilitare le interazioni proteina con altre molecole, il centro attivo di queste parti è spesso dove l' parti, o il sito di legame allosterico. Stato Alcuni di proteine globulari di una catena peptidica, o covalentemente legato a due o più catene polipeptidiche nella struttura spaziale può essere suddivisa in diverse sotto-struttura sferica in cui ciascuno di struttura sferica è indicato come un sottodominio . Con una proteina tra i vari domini della catena peptidica viene collegati tra loro, mentre la stragrande maggioranza di collegare i due domini sono a singolo filamento catena peptidica, solo in casi rari avrà una manciata di doppio filamento legami peptidici catena diversi domini strutturali. Nel diagramma di diffrazione di raggi X disegnata densità elettronica, può essere visto chiaramente che alcune delle proteine globulari porzione ad alcune crepe, queste crepe che ciascuna parte del collegamento tra i domini, mentre il collegamento tra i domini è allentato , ma ancora appartengono alla stessa catena peptidica da catene peptidiche e proteine che legano le varie interazioni di non legame tra le subunità mantengono la struttura si basa essenzialmente diverso. Nel dominio spazio che è una stretta correlazione tra il livello struttura dei residui amminoacidici che sono adiacenti nella struttura tridimensionale del dominio anche adiacenti l'uno all'altro nella struttura primaria di residui di amminoacidi uno dall'altro nel dominio la struttura spaziale sono lontani gli uni dagli altri, anche appartenenti a domini diversi. Proteina completa domini funzioni fisiologiche strettamente legati, a volte diversi domini insieme per realizzare una funzione fisiologica, e qualche volta un dominio può completare in modo indipendente una funzione fisiologica, ma una struttura di dominio incompleto 'improbabile che fisiologico funzione. Pertanto, le funzioni fisiologiche dei domini proteici della base strutturale, si deve osservare che, anche se la funzione di un dominio di proteina e stretto, ma la struttura e la funzione del dominio non è lo stesso concetto di un dominio. Scarto Motif (motivo) che sia le strutture super-secondarie, in breve, è una combinazione di struttura secondaria regolare. Per esempio elica - loop - elica, combinazioni piega beta Una combinazione, mentre la Francia spirale. Un altro esempio è la leucina zipper, zinco motivi dita sono tipici Eseguono una certa funzione, che sia la struttura del gruppo stampi corpo, e le unità funzionali, possono essere usati direttamente come dominio e struttura terziaria dei mattoni. Alcuni fattori proteici e del DNA principali siti di legame della scanalatura si affidano a qualche motivo specifico. Dominio (dominio) è una grande molecola proteica nella formazione di alcuni della struttura spaziale può essere identificato, la zona di compressione è spesso zona di compressione sferica o fibroso. Inoltre entrambi una unità strutturale è l'unità funzionale. Tale zona è il dominio di immunoglobulina della funzione. Ovviamente domini corpo dello stampo ed è un concetto diverso. |
| Utente Recensione |
|
Ancora nessun commento |