| Lingua : |
|
| Comunità Encyclopedia |Enciclopedia Risposte |Invia domanda |Conoscenza Vocabolario |Carica conoscenza |
Volatilità relativa |
     |
|
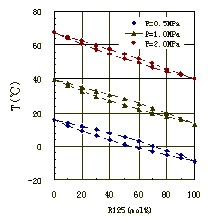
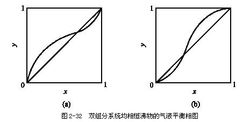
Breve introduzione Volatilità relativa: consuetudine componenti volatili in grado soluzione volatilizzazione delle componenti volatili del volatilità duro, è noto come volatilità relativa. Espressa da α. Definizione della relativa formula α volatilità α = (yA / yB) / (xA / xB), la formula, yA - la fase vapore frazione molare del componente volatile; yB - componenti meno volatili nella frazione molare fase vapore;xA - liquido frazione molare fase della componente volatile; xB - componente meno volatile nella frazione molare fase liquida. Derivazione specifica Rappresenta due del rapporto di fase gas della frazione molare nella fase liquida in equilibrio con due volte il rapporto molare frazione α. Miscela liquida di due componenti nel rapporto di rapporto di equilibrio. Componente A componente B, la volatilità relativa di XAB può essere espresso come: αAB = KA / KB (1) KA e KB, in cui i componenti A e B rispettivamente, il rapporto di equilibrio (cfr. processo di separazione di massa). La stessa miscela, il componente volatile di un grande rapporto di equilibrio generale, i componenti volatili sulla volatilità relativa del componente meno volatile è maggiore di 1, altrimenti meno di 1. Rapporto di equilibrio è definito secondo la formula (1) può essere riscritta come: Equazione 2. Dove xA e yA componente A erano in fase vapore e la frazione molare fase liquida; yB e xB, rispettivamente, di componente B in fase vapore e la frazione molare fase liquida. Per i componenti A e B forma una miscela a due componenti, yA = 1-yB, xA = 1-xB. Che può portare avere: Equazione 3 (3) mostra che: se αAB maggiore di 1, yA rispetto xA, cioè per aumentare la concentrazione fase vapore del componente A, A è il componente più volatile. αAB hanno più di 1, allora xA yA è sufficientemente grande rispetto alla più; come αAB meno di 1, a meno di yA xA, il componente B che si arricchisce in fase vapore ottenuto, B è il componente più volatile. αAB il più abbastanza piccolo, allora la concentrazione B nella crescita fase vapore più notevole. Quando αAB uguale a 1, quindi yA eguagliare xA, suggerendo che questo non può essere separata dalla miscela distillazione. Pertanto, il grado di deviazione con un 1 αAB distillazione è la facilità di separazione del liquido simbolo miscele. Quando la miscela nella fase liquida e la fase vapore è una soluzione ideale, gas ideale, l'applicazione della pressione parziale della legge di Raoult e legge di Dalton, dalla formula (2) derivata: αAB = P2/P1 Dove p1 e p2, rispettivamente, i componenti A e B sono saturi pressione di vapore. A questo punto la volatilità relativa della pressione di vapore saturo di due componenti (una misura della componente puro volatilità) Rapporto. Per il sistema ideale, la volatilità relativa della composizione miscela e la dipendenza dalla temperatura è molto piccolo, può essere considerato costante ingegneria. Ma la forte concentrazione su sistemi non ideali relative volatilità ha un impatto maggiore. Inoltre, talvolta nell'industria aggiungendo la miscela da separare un certi additivi per aumentare la volatilità relativa tra i componenti, rendono difficile utilizzare una miscela di distillazione normale diventa facile da separare. Questa è la distillazione estrattiva, distillazione azeotropica e di rettifica, e altri particolari di rettifica sale base fondamentale. |
| Utente Recensione |
|
Ancora nessun commento |