| Lingua : |
|
| Comunità Encyclopedia |Enciclopedia Risposte |Invia domanda |Conoscenza Vocabolario |Carica conoscenza |
Idrossido di calcio |
   |
|
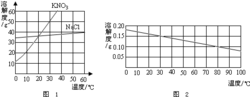
Nome cinese: idrossido di calcio Nome straniero: idrossido di calcio Formula chimica: Ca (OH) 2 Peso: 74.09CAS :1305-62-0 Pericolo: Corrosivo Tipo normativo: non regolato Idrossido di calcio è un solido bianco polverulento. Conosciuto anche come la calce, calce spenta. Idrossido di calcio ha una base di continuità, è una base forte. Tuttavia, idrossido di calcio è fortemente alcalina di idrossido di sodio (metallico: Ca> Na), dal momento che la solubilità di idrossido di calcio, idrossido di sodio, più piccolo, la soluzione corrosiva di idrossido di calcio e un rapporto di idrossido alcalino sodio piccola. Queste proprietà del idrossido di calcio è ampiamente utilizzato. Proprietà fisiche e chimiche Polvere bianca, solubile in acido, sale di ammonio, glicerina, poco solubile in acqua, insolubile in alcool, un forte alcalina (alcalina forte di idrossido di sodio), pelle, tessuti hanno un effetto corrosivo. La densità relativa di 2,24. È stato riscaldato a 580 ℃ disidratazione di ossido di calcio, anidride carbonica dall'aria di assorbire il calcio. Utilizzare Preparazione di cemento, calce, preparazione della poltiglia bordolese come pesticida. Cambiando il pH del terreno sarà la giusta quantità di calce aggiunta al suolo, può neutralizzare l'acido, cambiando il pH del terreno. Ricette di additivo alimentare di idrossido di sodio, producendo candeggina Per la produzione di carbonato di calcio, epicloridrina, ossido di propilene, candeggina, polvere decolorante, disinfettanti, solo l'acido, agenti astringenti, addolcimento, suolo acidità agente impedendo, agenti depilatori, tamponi, neutralizzanti, agenti e farmaci essiccazione; utilizzati in gomma, additivi petrolchimici, come l'industria petrolifera aggiunti all'olio lubrificante per impedire coke, fanghi di deposizione, in e corrosione. [1] Causticità La sua polvere o goccioline di aerosol hanno un effetto stimolante sulla mucosa, anche se non così buono come idrossido di sodio pesante misura, ma possono anche causare starnuti e tosse, e le basi, come fare emulsione di grasso, dalla pelle di assorbire l'umidità, proteine disciolte, l'irritazione dei tessuti e alla corrosione. Lime inalazione di polveri può causare la polmonite. Concentrazione massima ammissibile di 5 mg / m³. Inalazione di polvere, vapore acqueo può essere inalato, codeina e ancora Aoning, rivestito in crema di senape al torace, quando nell'occhio, l'acqua disponibile risciacquo appena possibile, e poi la soluzione di cloruro di ammonio 5% o 0,01% Ca-EDTA soluzione, risciacquo, e poi la soluzione 0,5% tetracaina stato aggiunto goccia a goccia. I lavori dovrebbero prestare attenzione a proteggere le vie respiratorie, indossare una tuta con una fibra antipolvere, guanti, occhiali, polvere sigillato e rivestito con unguento grasso per evitare l'inalazione di polvere. Analisi Scioglimento Materiale più solido disciolto in acqua assorbe calore, con movimento bilanciato principio, quando la temperatura aumenta, il bilancio termico a favore della direzione, quindi, la solubilità di queste sostanze aumenta con la temperatura, come KNO ₃, NH ₄ NO ₃ e così via. Ci sono poche sostanze disciolte quando fenomeno esotermico, in generale, la loro solubilità diminuisce all'aumentare della temperatura, come idrossido di calcio. Solubilità di idrossido di calcio, come la temperatura aumenta con la questione, non vi è una spiegazione ha due idrato idrossido di calcio [Ca (OH) ₂ · 2H ₂ O e Ca (OH) ₂ · 12H ₂ O]. Sia più grande idrato solubilità, anidro molto bassa solubilità di idrossido di calcio. Mentre la temperatura aumenta, il cristallino idrato anidra di idrossido di calcio cambia gradualmente, pertanto, la solubilità di idrossido di calcio diminuisce all'aumentare della temperatura. Sistema interpreta la solubilità di idrossido di calcio in gran parte al di là del campo di applicazione della conoscenza del curriculum media inferiore. Sciogliendo il composto ionico possono essere suddivisi in due processi. Prima di solida affinità composto ionico con solvatazione acqua si verifica (composto ionico può essere semplicemente considerato prima con "elementi" in forma in un solvente), allora questi solventi sono entrati "molecolare" forma ioni ionizzazione si verifica. Processo 1 (cioè, il processo di ionizzazione) può essere solo un processo endotermico (dal punto di vista del potenziale dell'energia elettrica concepibile sistema). Il 2 di processo (cioè il processo di solvente) non è necessariamente l'effetto termico. Nostra solido Ca (OH) ₂ solubile in acqua come un esempio. Sistema prima scioglimento di idrossido di calcio solido e acqua. Per il processo 2:. Ca (OH) ₂ (solido) nH ₂ O → Ca (OH) ₂ NH ₂ O (soluzione) effetto termico dipende dalla idrossido di calcio è con acqua per formare complessi che Ca (OH) ₂ NH ₂ O in forma di. (valore di n dipende elettrone orbita vuota del numero calcio e altre condizioni esterne, quali condizioni di temperatura, ecc.) Di fatto l'energia e calcio idrossido con acqua per forma e sostanza. La formazione di complessi del processo è un processo esotermico. Il processo può verificarsi con la formazione di 2 (ossia ionizzazione): Ca (OH) ₂. NH ₂ O → Ca (H ₂ O) n2 2 OH- Poiché le molecole di calcio e acqua con l'effetto esotermico processo è grande, è incluso nel Processo 1, sopra il processo 1 e 2, l'altro processo un effetto termico nel processo, il processo di scioglimento di idrossido di calcio l'effetto calore totale è messo calore. Processo di equilibrio di temperatura si dissolverà nella direzione opposta, quindi la solubilità di idrossido di calcio diminuisce all'aumentare della temperatura. Dopo che il sistema dissoluzione energia totale maggiore di confronto viene disciolto prima del dissoluzione. Eccesso di energia sotto forma di rilascio di calore. [2] |
| Utente Recensione | Tutto Recensione [ 1 ]>>> |
| ||||